
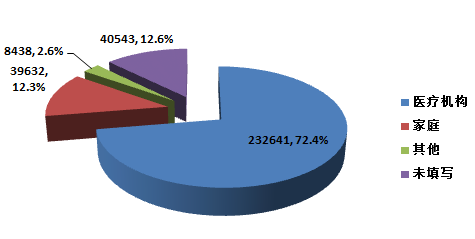
2015年,全国上报的可疑医疗器械不良事件报告中,使用场所为“医疗机构”的报告232★★,641份★★,占72.4%★★★;使用场所为“家庭”的报告39,632份★★,占12.3%★★★;使用场所为“其他”的报告8★★,438份★,占2.6%★★;使用场所未填写的报告40,543份★,占12★★★.6%(图2-4)。使用场所的复杂性是分析不良事件发生原因时需要考量的因素之一★★。
2.医疗器械不良事件:指获准注册或已备案、质量合格的医疗器械★★★,在正常使用情况下发生的★,导致或可能导致人体伤害的各种有害事件。
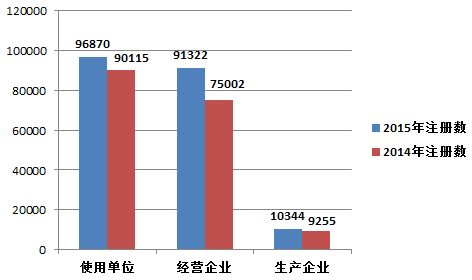
2015年,注册基层用户(包括医疗器械生产企业、经营企业和使用单位)总数比2014年增长了13★.9%★。其中,医疗器械生产企业、经营企业和使用单位的注册基层用户分别比2014年增长了11.8%★★、21★★.8%和7.5%(图1-5)。
2015年,全国医疗器械不良事件监测工作继续稳步发展,全年可疑医疗器械不良事件报告数已超过32万份。在报告数量持续增长的同时,报告质量也不断提升,为医疗器械上市后风险的分析与评价提供了依据★★★。
低频电磁治疗设备临床使用风险主要以电能危害为主★,其中人员伤害的主要表现为皮肤过敏、烫伤、灼伤★★★、刺痛★、疼痛及肌肉麻木等;器械故障的主要表现有:漏电,无输出或输出不稳定★★★,电极片★、导联线损坏等。为加强低频电磁治疗设备的安全使用,减少不良事件的发生,提醒使用者:1.严格控制适应症及禁忌症,按照产品使用说明书正确使用★,切勿超输出功率★、超时长等非正常使用,确保设备的使用环境和使用条件符合要求;2★★★.加强设备的日常检查和维护保养★★,及时更换易损、易耗件★★★。
(1)医疗器械不良事件主要是由于产品的设计缺陷、已经注册审核的使用说明书不准确或不充分等原因造成的,但其产品的质量是合格的。
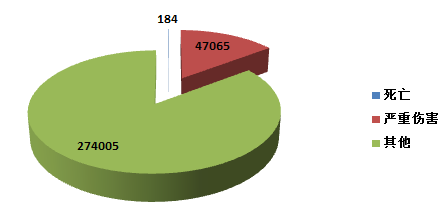
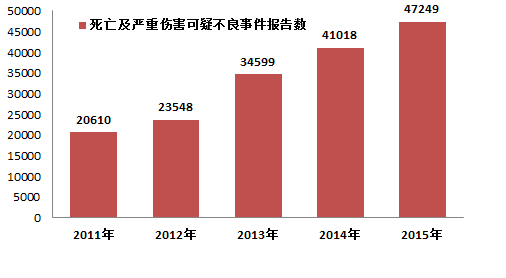
2015年,国家药品不良反应监测中心共收到死亡可疑不良事件报告184份,严重伤害可疑不良事件报告47,065份,共计47,249份,比2014年增长了15★★.2%(图1-2)★★★。2015年死亡及严重伤害可疑不良事件报告数量占报告总数的比例为14★.7%,比2014年下降了0★★★.8%。
总体来看,不良事件报告仍主要来源于使用单位。相比2014年,生产企业提交的报告所占比例有所下降,与其器械使用安全第一责任人的地位不符,其履行职责的自觉性有待提高。
2015年,总局共发布3期《医疗器械不良事件信息通报》,涉及医用血管造影x射线机、体外除颤器和低频电磁治疗设备三类产品。
(3)医疗事故是指医疗机构及其医务人员在医疗活动中,违反医疗卫生管理法律★、行政法规、部门规章和诊疗护理规范、常规,过失造成患者人身损害的事故。(摘自卫生部《医疗事故处理条例》)
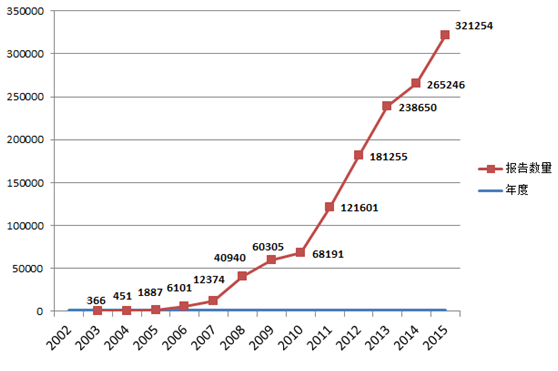
2015年,国家药品不良反应监测中心共收到《可疑医疗器械不良事件报告表》321,254份,比2014年增长了21.1%。2002年1月1日至2015年12月31日,国家药品不良反应监测中心累计收到《可疑医疗器械不良事件报告表》1,322★,059份(图1-1)。
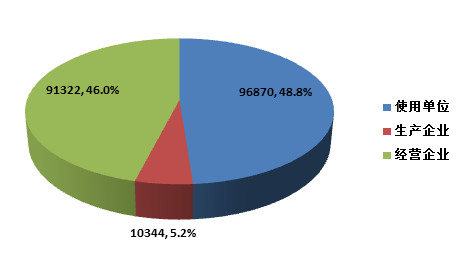
截止2015年12月31日,在全国医疗器械不良事件监测系统中★★,注册基层用户(包括医疗器械生产企业★★★、经营企业和使用单位)共198, 536家。其中,医疗器械生产企业10,344家,占注册基层用户总数的5.2%;经营企业91★★,322家★,占注册基层用户的46.0%;使用单位96,870家,占注册基层用户的48.8%(图1-4)。
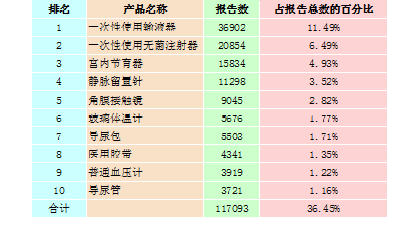
2015年,全国上报的可疑医疗器械不良事件报告中,报告数量排名前十位的无源医疗器械分别为一次性使用输液器、一次性使用无菌注射器、宫内节育器★、静脉留置针、角膜接触镜、玻璃体温计、导尿包、医用胶带、普通血压计和导尿管★,占总报告数的36.45%★★,详见表2-2★★。
根据医疗器械不良事件的危害程度和发生的原因,医疗器械生产企业必要时应当采取警示★、检查★★、修理、重新标签、修改说明书、软件升级★★、替换、收回★★、销毁等控制措施★★。
医用血管造影X射线机的临床使用风险主要表现为造影机故障★★。这些故障主要包括无射线,设备无法启动、死机、自动关机,图像不清晰★★★,图像不能保存★★★,机架臂无法锁死,手术床无法移动等。其中以球管和操作台的故障报告最多。为减少不良事件重复发生造成伤害的风险,建议生产企业在产品设计中★,增加对易老化★、易损耗部件状态的监测,必要时增加报警信息,以便于使用者及时识别★★★;加强对医疗机构的使用培训,包括设备的操作规程、运行环境要求、易损件的使用寿命等。建议医疗机构详细阅读设备使用说明书,熟悉操作规程和使用注意事项★★,严格按照使用说明书的要求保证设备运行环境★★★。
3.医疗器械不良事件监测:是指对医疗器械不良事件的发现、报告、调查、评价和控制的过程★★★。
1.医疗器械★★★:是指直接或者间接用于人体的仪器★★★、设备、器具★★★、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件★;其效用主要通过物理等方式获得★★★,不是通过药理学、免疫学或者代谢的方式获得★★,或者虽然有这些方式参与但是只起辅助作用★★★;其目的是:
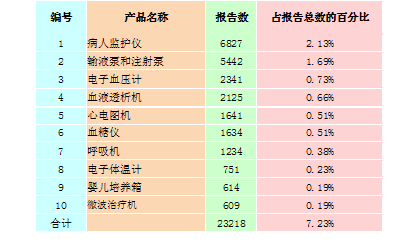
2015年★★,全国上报的可疑医疗器械不良事件报告中,报告数量排名前十位的有源医疗器械分别为病人监护仪、输液泵和注射泵、电子血压计、血液透析机★★★、心电图机、血糖仪、呼吸机、电子体温计、婴儿培养箱和微波治疗机,占总报告数的7.23%,详见表2-3。
体外除颤器临床使用风险主要表现为:心脏除颤功能失效★、监视器或记录器失效或受扰紊乱。为减少不良事件重复发生造成伤害的风险,提醒使用单位根据相关国家标准和行业标准,及所使用体外除颤器的随机文件要求,建立并严格执行体外除颤器的日常维护机制;生产企业应考虑除颤器的特殊性(高风险、不常使用)★★★,尽量通过“机宜人”的设计使产品易于维护,并且加强关键部件的可靠性设计,以减少设备故障的发生★★。
(2)医疗器械质量事故主要是指其质量不符合注册产品标准等规定造成的事故。
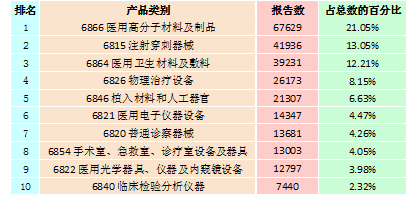
按照现行的《医疗器械分类目录》,2015年全国上报的可疑医疗器械不良事件报告共涉及43类产品,涵盖了《医疗器械分类目录》中的所有医疗器械类别。其中,报告数量位列前十位的产品类别见表2-1。与2014年相比,报告数量排名前十位的产品类别没有变化,仅部分产品类别的排名略有变化。
目前,我国医疗器械不良事件监测按照★★★“可疑即报”原则收集报告★★★,即为可疑医疗器械不良事件报告。
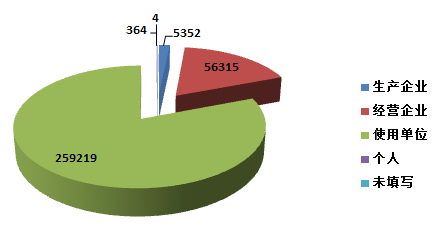
2015年,全国上报的可疑医疗器械不良事件报告中★★,使用单位上报259,219份,占总报告数的80.6%;生产企业上报5★★★,352份★★,占总报告数的1.7%;经营企业上报56,315份★★,占总报告数的17.5%;还有364份报告来自于个人,占总报告数的0.1%★★;此外还有4份报告来源不详(图2-1)。
6.平均百万人口报告数:平均每1百万人口中收到的可疑医疗器械不良事件报告数。
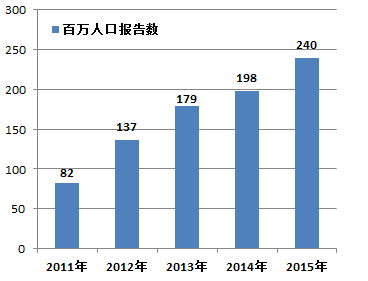
2015年,我国每百万人口平均可疑医疗器械不良事件报告数为240份,与2014年相比增长了42份(图1-3)。
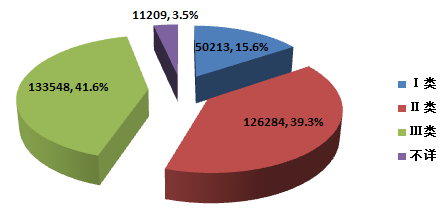
2015年,全国上报的可疑医疗器械不良事件报告中,涉及Ⅲ类医疗器械的报告133★,548份★,占总报告数的41★★.6%;涉及Ⅱ类医疗器械的报告126,284份,占总报告数的39★★★.3%;涉及Ⅰ类医疗器械的报告50★,213份,占总报告数的15.6%;部分报告涉及的器械管理类别不详,共11,209份,占总报告数的3.5%★★。数据显示,涉及Ⅲ类和Ⅱ类医疗器械的报告占绝大多数,这与医疗器械风险程度高低相吻合(图2-3)★★★。
2015年★★,全国上报的可疑医疗器械不良事件报告中,事件伤害为死亡的报告共184份,占总报告数的0.05%★;事件为严重伤害的报告共47,065份,占总报告数的14.7%;事件伤害为其他的报告共274,005份,占总报告数的85.2%(图2-2)。2015年,各类伤害程度的报告绝对数量均有所增加,其所占比例与2014年相似。
2015年★,国家药品不良反应监测中心共发布9期《医疗器械警戒快讯》,包括52条国外医疗器械监管机构发布的安全性信息,涉及血管内回收钳★、麻醉呼吸回路、除颤器、胰岛素泵★★、呼吸机★、人工晶体等产品。